Молекулярно-генетическое исследование вируса мешотчатого расплода пчёл

Мешотчатый расплод – одна из распространенных вирусных болезней пчел, которая регистрируется на всех континентах (Aubert, Ball et al., 2008). Сведения по мешотчатому расплоду в СССР известны, начиная с первой половины прошлого века. По результатам исследований патологического материала, поступающего в ВНИИ экспериментальной ветеринарии, вирус мешотчатого расплода является наиболее частой причиной гибели пчелиного расплода на пасеках многих регионов, в том числе крупных пчелоразведенческих хозяйств. Подробности можно найти в статье «Мешотчатый расплод» (Пчеловодство 2010, № 10). В настоящей работе приведены новые сведения о клинических признаках болезни и новые данные по генетическим особенностям ее возбудителя.
В справочниках по болезням пчел обычно приводят классические признаки мешотчатого расплода – это погибшие личинки пчел в виде мешочков, заполненных жидкостью.
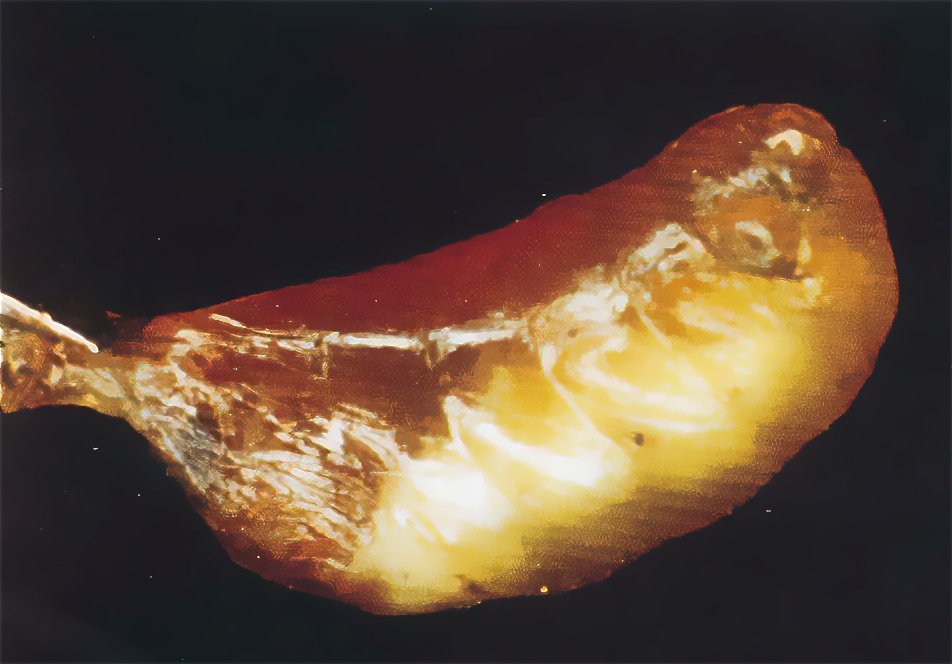
Однако обнаружить таких личинок можно только в случае тяжёлого протекания болезни. Часто в семьях пчёл, неблагополучных по мешотчатому расплоду, найти больных и погибших личинок почти невозможно. Пчёлы обнаруживают их и оперативно удаляют из улья.
Специалист по болезням пчел L. Bailey (Англия) проводил эксперименты по инкубации печатного расплода в термостате при отсутствии взрослых пчел. Был использован расплод из разных семей пасеки, неблагополучной по мешотчатому расплоду. Установлено, что до 6% личинок могут погибать от этого вируса даже в семьях, которые казались абсолютно здоровыми. Таким образом, при невысокой степени поражения болезнь может оставаться незамеченной.
Известно, что кроме личинок рабочих пчел вирус может поражать личинок трутней. Однако в доступной литературе мы не нашли сведений о том, что именно на трутнёвом расплоде легче заметить болезнь, когда она протекает в лёгкой форме. Нами отмечено, что пчелы менее оперативно удаляют погибших личинок трутней (видимо из-за более тяжелого веса), а погибших куколок трутней часто разгрызают и выбрасывают по частям. Так же как и у личинок рабочих особей, гибель личинок трутней происходит после их запечатывания. Пчелы распознают ячейки с погибшими личинками и вскрывают их.
В норме открытые личинки лежат колечком на дне ячейки. Только после запечатывания они вытягиваются и начинают прясть кокон. Вытянувшиеся личинки в открытых ячейках указывают на патологию.
У пчеловодов выбрасывание личинок и куколок трутней обычно не вызывает особой тревоги. Считается, что это нормально. Пчелы, потратив столько сил на выращивание личинок трутней и доведя их до кондиции, вдруг одумались и решили выбросить этих дармоедов. На самом деле нормально, когда пчелы изгоняют трутней ближе к осени. В разгар сезона выбрасывание трутнёвого расплода указывает на болезнь. Скорее всего, то же самое происходит и с личинками рабочих особей, но менее заметно.
Иногда личинки, заражённые вирусом мешотчатого расплода, не погибают на стадии прядения кокона, переходят в стадию предкуколки и долго остаются живыми. У них не накапливается жидкость под личиночной кутикулой. Внешне они выглядят нормально и на первый взгляд непонятно, почему пчелы вскрывают их ячейки. Однако если присмотреться, то у некоторых предкуколок сквозь личиночную кутикулу можно увидеть пигментированные глаза. В норме у личинок нет органов зрения. Зачатки конечностей и глаза появляются у предкуколок под личиночной кутикулой, но они белые. Даже после завершения стадии предкуколки, сбрасывания личиночной кутикулы и образования куколки, её тело некоторое время лишено пигментации. В доступной литературе мы не нашли сведений о том, что на стадии предкуколки может происходить пигментация глаз.
Для доказательства того, что личинки и предкуколки содержат вирус мешотчатого расплода, мы использовали реакцию иммунодиффузии (РИД). Для идентификации вирусов пчёл эта серологическая реакция была впервые использована L. Bailey. Нами было показано, что предкуколки с пигментированными глазами содержат вирус в большом количестве. Следовательно, вирус мешотчатого расплода даже при интенсивном размножении в некоторых случаях не затрагивает жизненно важных органов.
Предкуколка долго остаётся живой, но её метаморфоз нарушается. В вышеприведённом примере практически все органы (кроме глаз) остановились в своём развитии. В других случаях куколка все же образуется, но с явными уродствами (нарушены пропорции между головой, грудью и брюшком, отсутствуют конечности). Куколка, поражённая вирусом, может и не иметь никаких внешних дефектов.
Таким образом, вирус мешотчатого расплода вызывает гибель не только личинок старшего возраста, но предкуколок и куколок.
Пчелы старше 8 дней невосприимчивы к вирусу мешотчатого расплода. Более молодые пчёлы могут заражаться и становятся вирусоносителями, какие-либо видимые симптомы болезни у них отсутствуют, но нарушается функция сбора пыльцы и сокращается продолжительность жизни.
В 1960-70 гг L. Bailey с помощью РИД исследовал большое количество образцов личинок европейской пчелы A. mellifera, собранных в разных странах, и не выявил серологических различий между обнаруженными в них изолятами вируса мешотчатого расплода. Вирус с небольшими отличиями физико-химических и серологических свойств был выделен L. Bailey et al. в 1982 г от погибших личинок азиатской пчелы Apis cerana, привезенных из Таиланда, и назван тайским вирусом мешотчатого расплода. В тот период тайский вирус мешотчатого расплода был широко распространен в семьях A. cerana в Таиланде, Бирме, Индии и Непале, где вызывал массовую гибель пчелиных семей, которая достигала 90-95%.
Ареалы европейских и азиатских пчел на протяжении многих тысяч лет не совпадали. Массовый завоз европейских пчел в ареал азиатских произошел в прошлом веке. По отдельным сведениям, первые случаи интродукции пчел датируются более ранним периодом, например, в Японию европейскую пчелу впервые завезли в 1877 г. (Kojima et al, 2011). Пчел этих двух видов местные пчеловоды часто содержали на одних и тех же пасеках, где возможно и произошел переход некоторых возбудителей болезней с одного вида пчёл на другой с дальнейшей адаптацией к новому хозяину. С вирусом мешотчатого расплода этого не произошло. В лабораторных условиях L. Bailey удалось заразить куколок европейской пчелы вирусом тайского мешотчатого расплода. Однако в естественных условиях для этого вируса, скорее всего, существует видовой барьер (Se-Eun Choe et al, 2011): у каждого вида пчел циркулирует только «свой» вирус.
По данным филогенетических исследований области РНК-полимеразы вирусов мешотчатого расплода, изолированных в разных географических местах и от разных видов пчел, выделяют три генотипа вируса: южно-африканский, европейский и азиатский
Что представляют собой штаммы вируса мешотчатого расплода, циркулирующие среди пчёл на территории России, до недавнего времени оставалось неизвестным.
Это и побудило нас провести исследования на молекулярно-генетическом уровне материала, в котором ранее методом РИД был установлен вирус мешотчатого расплода. Материал был собран в разные годы на пасеках Ставропольского Края (район Кисловодска), Республики Адыгея (Майкоп), Калужской, Оренбургской, Архангельской и Московской областей (в том числе от семей пчел, завезённых из Узбекистана).
Материал хранился в замороженном или лиофилизированном виде. Исследовали также лабораторный штамм Tr5 вируса мешотчатого расплода, культивируемый на куколках пчел и трутней методом микроинъекции. Идентификацию вируса проводили методами РИД и ПЦР (полимеразная цепная реакция). В РИД использовали сыворотки собственного производства, которые были получены иммунизацией кроликов вирионами, выделенными из погибших личинок с клиническими признаками мешотчатого расплода из Калужской области (сыворотка № 6), и вирионами, выделенными от погибших пчел с деформированными крыльями из Таджикистана (сыворотка № 58).
Образцы сывороток были отправлены в Великобританию (Rothamsted Experimental Station, Harpenden, Hertfordshire, UK), где их тестировала доктор Brenda V. Ball в РИД с разными вирусами пчел. Сыворотка № 6 давала положительный результат только с эталонным штаммом Rothamstead вируса мешотчатого расплода (титр антител 1:128). Сыворотка № 58 не реагировала с этим штаммом, но реагировала с вирусом деформации крыльев (титр антител 1:64).
В ПЦР материал исследовали со специфическими праймерами к вирусам мешотчатого расплода (Tentcheva, 2004; Grabensteiner, 2001), деформации крыльев (Maori, 2007; Berenyi, 2006), острого паралича (Tentcheva, 2004), Кашмир (Stoltz et al.,1995; Maori, 2007), черных маточников (Maori, 2007).
Во всех исследованных образцах подтверждено наличие вируса мешотчатого расплода. В двух пробах выявили присутствие одновременно двух вирусов – мешотчатого расплода и деформации крыльев. Никакие другие вирусы из вышеперечисленных в исследованных пробах не обнаружили.
Для трех изолятов и лабораторного штамма вируса мешотчатого расплода была определена первичная структура фрагмента РНК-полимеразы (последовательности зарегистрированы в международной базе данных GenBank под номерами JN83572-JN83575) и проведен филогенетический анализ. На полученной филограмме можно выделить 4 группы, или генотипа, из которых группы 1-3 были впервые описаны Grabensteiner et al. (2001). Европейский генотип (группа 1) с эталонным штаммом из Великобритании объединяет вирусы Центральной Европы (Германия, Франция, Австрия, Венгрия, Испания) и Великобритании. В этой же группе вирусов оказались изоляты 207/4 и 212/3, выделенные в России (Московская обл. и Кисловодск, соответственно), гомология между которыми составляет 99%. Ближайшие их родственники присутствуют в Германии и Франции.
К азиатскому генотипу (группа 2) принадлежат вирусы из Южной Кореи, Китая, Непала, Индии и Японии. Среди них находится и тайский вирус мешотчатого расплода. Южноафриканский генотип (группа 3) представлен одним изолятом из Южной Африки.
На обособленной ветви (группа 4) оказались два наших изолята: лабораторный штамм Tr5 и изолят 202/8, выделенный от семьи пчел, завезенной из Узбекистана. Гомология между ними составляет 94,2%, в то время как с представителями других групп она не превышает 80,6-83,5%.
Генетическое расстояние в пределах одной группы колеблется от 0,01 (группа 2) до 0,06 (группы 1 и 4), а между группами от 0,1 (группы 1 и 2) до 0,25 – 0,28 (группы 3 и 4). На этом основании группа 4 может быть выделена в самостоятельный генотип.
Исследуемые в настоящей работе изоляты 1-ой и 4-ой генетических групп вируса мешотчатого расплода по-разному вели себя в РИД с сыворотками № 6 и № 58. Все изоляты 1 и 4 геногрупп, положительно реагировали с сывороткой № 6 подобно эталонному штамму Rothamstead (Великобритания) вируса мешотчатого расплода европейского генотипа. C сывороткой № 58 положительно реагировали только изоляты 4 геногруппы вируса мешотчатого расплода и изоляты вируса деформации крыльев.
В перекрёстной реакции между вирусом мешотчатого расплода 4 геногруппы и вирусом деформации крыльев серологического родства не выявлено. Таким образом, в наших экспериментах было установлено, что сыворотка № 58 содержит антитела не только к вирусу деформации крыльев в титре 1:64, но и к вирусу мешотчатого расплода генотипа 4 в титре 1:8. С вирусом мешотчатого расплода европейского генотипа (группа 1) реакция отсутствовала, что согласуется с данными B.V.Ball (см. выше). По всей видимости, материал из Таджикистана, который использовали для получения сыворотки № 58, содержал два морфологически схожих вируса – деформации крыльев и мешотчатого расплода генотипа 4.
На основании проведенных исследований можно сделать вывод о существовании двух генотипов вируса мешотчатого расплода у пчел A. mellifera на территории Российской Федерации. Один из них принадлежит европейской группе. Второй образует самостоятельную группу 4, ранее никем не описанную, которая занимает промежуточное положение между вирусами азиатского (гр.2) и южноафриканского (гр.3) генотипов.
Источником вируса мешотчатого расплода генотипа 4 в одном случае была семья пчел из Узбекистана (изолят 202/8), в другом (материал, используемый для иммунизации) из Таджикистана (сыворотка № 58). Тем не менее, мы воздерживаемся от присвоения генотипу 4 вируса мешотчатого расплода названия по территориальному признаку (например, среднеазиатский), поскольку слишком мало данных имеется о его распространении. Подробную информацию о материалах и методах наших исследований можно найти в журнале «Молекулярная генетика, микробиология и вирусология», 2012, №3.
Литература
- Батуев Ю.М. // Пчеловодство.-2010.- №10.-С. 24-27.
- Ломакина Н.Ф., Батуев Ю.М. // Молекулярная генетика, микробиология и вирусология, 2012, № 3 (в печати).
- Grabensteiner E, Ritter W, Carter MJ. et al. Clin Diagn Lab Immunol. 2001. V.8 (1).P. 93-104.
- Термин предложен Se-Eun Choe et al. (2011) вместо использованного ранее «дальневосточного генотипа» (Grabensteiner et al, 2001).
- Структура полного генома приведена в Genbank (AF092924). Штамм имеет европейский генотип.
Батуев Ю.М., Ломакина Н.Ф.
ВНИИ экспериментальной ветеринарии им. Я.Р. Коваленко, г. Москва
Количество просмотров: 8416
Назад в раздел


 Да (2)
Да (2) Нет (0)
Нет (0)



